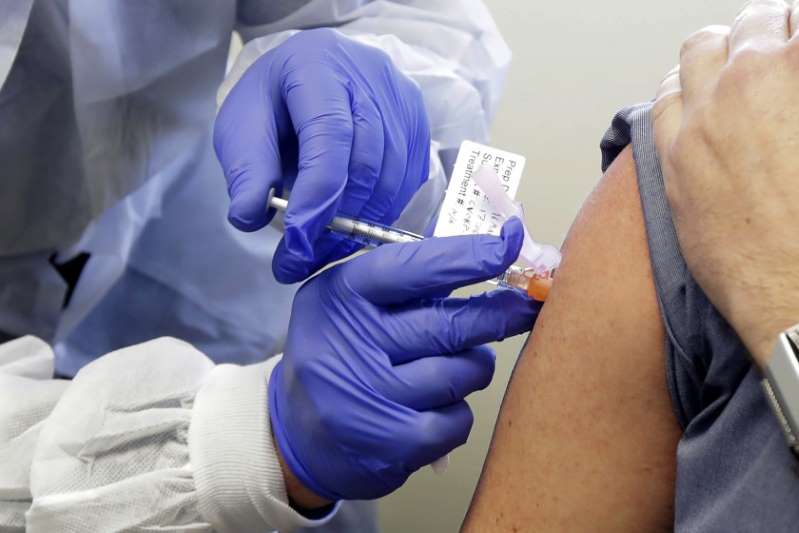
Mientras la pandemia cubre una franja cada vez más amplia del país, el anuncio de Moderna, de que según datos preliminares su vacuna contra el COVID-19 tendría una efectividad del 95%, ofreció a los estadounidenses una muy necesaria inyección de esperanza.
Fue la segunda vez en dos semanas que los monitores de seguridad independientes examinaron los datos de los ensayos clínicos y determinaron que la vacuna experimental funcionaba por encima de las expectativas. La semana pasada, Pfizer, en colaboración con su socio alemán BioNTech, afirmó también que su vacuna marcó un 90% de efectividad para prevenir los síntomas de la enfermedad.
“La luz al final del túnel se está volviendo un poco más brillante”, expresó el Dr. William Schaffner, experto en enfermedades infecciosas y medicina preventiva de la Universidad de Vanderbilt.
La noticia se produce a medida que varios estados emiten nuevas órdenes de cierre para detener una tercera ola de infecciones por coronavirus. Solo la semana pasada se registraron más de un millón de casos nuevos, y más de 1.100 estadounidenses mueren cada día.
Pfizer y Moderna aún no publicaron datos detallados de esta etapa final de los ensayos clínicos, y los resultados pueden cambiar cuando estén completos. Pero muchos expertos se muestran optimistas de que la distribución inicial de estas vacunas podría comenzar a finales de año.
“Los resultados de Pfizer, y ahora de Moderna, me animan mucho”, reconoció el Dr. Buddy Creech, director del programa de investigación de vacunas del Centro Médico de la Universidad de Vanderbilt. “Los niveles de eficacia superan nuestras expectativas, lo cual nos da la firme esperanza de que veremos el fin de la pandemia cuando la vacunación generalizada sea posible”.
Aquí hay un vistazo más de cerca de la situación con estas primeras vacunas.
¿Qué significa que una vacuna sea 90% o 95% efectiva?
Los ensayos clínicos miden qué tan buenas son las vacunas experimentales para reducir el riesgo de que una persona se infecte con el coronavirus que causa el COVID-19.
Para ello, los investigadores reclutaron voluntarios que recibieron dos dosis de la vacuna o un placebo, sin saber cuál era cuál. Luego se les animó a continuar con sus actividades cotidianas.
Los ensayos incluían una evaluación después de que un número determinado de antemano de voluntarios contrajera COVID-19. Moderna, por ejemplo, inscribió a 30.000 participantes y planeó cesar después de que se registraran 151 casos.
Hasta ahora, 95 personas se han enfermado, lo cual fue suficiente para que la junta de monitoreo de datos proporcionara una evaluación temprana de la eficacia de la vacuna. Los participantes seguirán siendo evaluados para ver cómo funciona la inmunización con el tiempo.
La conclusión fue que después de tres meses de exposición en comunidades típicas de todo el país, alrededor de 29.900 sujetos en el ensayo de Moderna permanecieron libres de síntomas. De los 95 que se enfermaron con COVID-19, 90 estaban en el grupo de placebo y cinco habían sido vacunados.
Esta información permitió a la junta de revisión concluir que la vacuna tiene una efectividad del 94.5%. Los datos aún se están evaluando para determinar por qué se enfermó el 5% de los inoculados.
Las cifras son similares a las del ensayo de Pfizer, que inscribió a 44.000 personas. Sin embargo, a diferencia de Moderna, Pfizer no proporcionó información sobre la gravedad de la enfermedad entre los participantes.
“La noticia sorprendente y esperanzadora es que la vacuna tuvo un efecto importante y positivo en la reducción de las enfermedades”, destacó el Dr. Larry Steinman, profesor de pediatría y ciencias neurológicas en la Universidad de Stanford, quien lideró el programa del departamento de inmunología durante una década.
¿Por qué no todos los voluntarios reciben la vacuna?
Los investigadores necesitan algo con lo cual comparar su vacuna para evaluar si es mejor, o peor, que no hacer nada. En este caso, el placebo es simplemente una solución salina.
Pero no solo los participantes desconocen si recibieron el tratamiento experimental o el placebo. Los investigadores que los examinan también lo ignoran. De esa manera, cuando evalúan la salud de un voluntario, no se ven influenciados por el conocimiento de que éste recibió o no la vacuna experimental.
“Los ensayos controlados con placebo son la mejor manera de eliminar el sesgo de la ecuación”, comentó Creech, de Vanderbilt. “Nos permiten ver qué tan bien funciona una vacuna. Asignar al azar y permanecer ‘ciegos’ en cuanto a qué recibió un voluntario permite juzgar mejor si la vacuna funciona”.
El diseño del estudio también ayuda a los investigadores a identificar los efectos secundarios causados por la vacuna. Por ejemplo, si los que recibieron el placebo se quejaron de dolor en los brazos tanto como los que recibieron la vacuna, sería razonable concluir que ello es resultado de la aguja y no necesariamente debido a los ingredientes activos del compuesto.
Si los resultados son tan buenos, ¿por qué siguen probando la vacuna?
Se necesita más tiempo para que una cantidad mayor de participantes del estudio se enfermen. Cuantos más casos haya, más podrán notar los investigadores que los resultados de los dos grupos de voluntarios son diferentes y que la vacuna funciona mejor que el placebo.
Algunos efectos secundarios también pueden tardar un tiempo en desarrollarse, y la prueba debe durar lo suficiente para que tengan oportunidad de aparecer.
En general, los ensayos clínicos pueden cesar antes de lo programado si los primeros datos hacen evidente que un medicamento experimental es completamente ineficaz, o cuando los resultados son tan favorables que ya no es éticamente responsable negárselo a quienes recibieron el placebo.
¿Qué efectos secundarios se observaron hasta ahora?
Todos han sido mínimos. Algunos participantes informaron dolor en el brazo durante uno o dos días. Otros se quejaron de dolores de cabeza y fatiga, así como de dolores musculares generales. Ninguno de estos se considera una reacción adversa grave.
Incluso los ensayos de este tamaño podrían no ser capaces de detectar eventos adversos muy raros, razón por la cual incluso después de que se aprueba una vacuna, los sistemas de monitoreo siguen buscando eventos raros en la población en general.
¿Cuándo estarán los resultados finales de las vacunas de Moderna y Pfizer?
Estos ensayos clínicos se diseñaron como estudios de dos años, por lo cual no está claro cuándo estarán disponibles los resultados finales. Sin embargo, estos son necesarios para que la Administración de Alimentos y Medicamentos (FDA), que tiene la tarea de examinar nuevos remedios para el uso público, decida si otorga la autorización de uso de emergencia a cualquier vacuna contra el COVID-19 y permite que esté disponible para el público. De concederse dicha autorización, las vacunas podrían comenzar a distribuirse en diciembre.
¿Actualmente se están probando otras candidatas?
Las vacunas que están desarrollando AstraZeneca y Johnson & Johnson también se consideran contendientes viables.
Ambos laboratorios se encuentran en las últimas etapas de sus ensayos clínicos, y la inscripción continúa en todo el mundo. Estas vacunas se fabrican de forma ligeramente diferente a las de Pfizer y Moderna, pero debido a que atacan la misma proteína en la superficie del virus, “tenemos mucha confianza en que podrían disfrutar de una eficacia similar”, consideró Creech.
¿Qué tan pronto podría vacunarme?
Si la FDA emite una autorización de uso de emergencia, los Centros para el Control y la Prevención de Enfermedades (CDC) estarán a cargo de supervisar la distribución de la vacuna al público. Los estados también desarrollarán sus propios planes. Si bien todavía hay mucha incertidumbre, ya está claro que al principio no habrá suficientes dosis para todos.
Los esquemas de priorización temprana ponen a los trabajadores de la salud al frente de la línea. A ellos se unirán personas mayores y gente con afecciones médicas subyacentes, porque esos grupos tienen más probabilidades de enfermar gravemente si se infectan.
Tanto Pfizer como Moderna informaron públicamente que tendrán alrededor de 20 millones de dosis para fin de año, pero los expertos creen que se necesitará hasta finales de la primavera o principios del verano para producir suficientes dosis para inmunizar a la mayoría de los residentes de EE.UU.
De todas maneras, los especialistas enfatizan que los protocolos de salud pública, como el uso de mascarillas y mantener la distancia social, deberán permanecer vigentes durante meses o incluso años después de que las vacunas estén disponibles por primera vez.
Lo que queda por responder es si estas vacunas evitarán que la gente se infecte. Por prometedores que sean estos ensayos, no se sabe si la vacuna detendrá la propagación del virus.
Este artículo fue publicado por primera vez en Los Angeles Times en Español.